Blutfette präzise einordnen
- Ricokernchen1

- 16. Okt. 2025
- 10 Min. Lesezeit
Von LDL/HDL zu ApoB, Lp(a) und Remnants
Ein verständlicher Leitfaden mit Praxisbeispiel
Viele Menschen bekommen ihre Blutfette in Tabellenform mit LDL, HDL, Triglyceride und bleiben mit der Frage zurück: Was heißt das für mein Herz‑Kreislauf‑Risiko, ganz konkret? Dieser Beitrag führt Schritt für Schritt durch die wichtigsten Werte und erklärt verständlich, was hinter den Fachbegriffen steckt. Er zeigt außerdem, warum moderne Marker wie ApoB, Lp(a), Remnant‑Cholesterin oder der TG/HDL‑Quotient häufig mehr über das Risiko verraten als die klassische Einzelzahl „LDL“. Abschließend deute ich exemplarisch echte Laborwerte (Januar 2025) und skizzieren, welche Maßnahmen sinnvoll sind.
Warum Blutfette überhaupt wichtig sind
"Blutfette" sind keine losen Fetttröpfchen, sondern in Lipoproteinen, das sind winzige Transportkügelchen aus Fett und Eiweiß, verpackt. Sie bringen Triglyceride, Energiespeicherfette, und Cholesterin, ein lebenswichtiger Baustoff für Zellwände und Hormone, dorthin, wo der Körper sie braucht. Problematisch wird es, wenn zu viele atherogene, also gefäßschädigende Partikel unterwegs sind und sich Bestandteile in der Gefäßinnenwand ablagern, das kann über Jahre Atherosklerose, umgangssprachlich "Gefäßverkalkung" fördern.
Wichtig zu verstehen, nicht die Cholesterinmenge allein entscheidet, sondern die Anzahl der "liefernden" Partikel. Diese Partikelzahl lässt sich mit ApoB besonders gut erfassen.
Die Klassiker richtig lesen! LDL, HDL, Triglyceride
LDL‑Cholesterin (Low Density Lipoprotein‑C; geringe Dichte) ist die klassische Zielgröße in vielen Befunden. Niedriger ist tendenziell besser, doch LDL‑C ist eine Masseangabe und kann das Risiko unter‑ oder überschätzen, wenn die Partikel ungewöhnlich groß oder klein sind. HDL‑Cholesterin (High Density Lipoprotein‑C; hohe Dichte) gilt oft als "Schutzfaktor", weil HDL am Rücktransport von Cholesterin beteiligt ist. Sehr hohe HDL‑Werte sind aber nicht automatisch besser, wichtiger ist die Gesamtkomposition. Triglyceride (TG) steigen typischerweise bei Insulinresistenz und hoher Kohlenhydratlast. Sehr niedrige TG gehen häufig mit einem günstigen Partikelprofil einher.
Eine hilfreiche Ergänzung ist das non‑HDL‑Cholesterin. Das ist einfach Gesamtcholesterin minus HDL und fasst alles zusammen, was ApoB‑haltig ist, also die potentiell atherogenen Partikelklassen. Es ist robuster als LDL‑C, besonders wenn die TG erhöht sind.
Moderne Kenngrößen, leicht erklärt
ApoB (Apolipoprotein B): Stellen Sie sich ApoB als "Seriennummer" vor, die jedes atherogene Partikel trägt. Also VLDL‑Remnants (Very Low Density Lipoprotein), IDL, LDL, auch Lp(a) trägt ein Partikel = ein ApoB. Je höher ApoB, desto mehr "Lieferfahrzeuge" mit Cholesterin sind im Blut unterwegs. Darum korreliert ApoB sehr gut mit dem tatsächlichen Risiko.
Lp(a), Lipoprotein(a) ist in genetisch festgelegtes "Spezial‑LDL" mit zusätzlicher Eiweißkomponente. Es erhöht das Risiko für Herz‑Kreislauf‑Ereignisse unabhängig von anderen Werten. Lp(a) ist weitgehend lebensstilunabhängig. Man misst es idealerweise einmal im Leben.
Remnant‑Cholesterin ist das Cholesterin in Restpartikeln (Remnants), die bei der Verstoffwechselung von Triglycerid‑reichen Lipoproteinen entstehen. Ein praktischer Näherungswert ist non‑HDL minus LDL. Remnants sind klein genug, um leicht in die Gefäßwand einzudringen und gelten als besonders atherogen.
sdLDL (small dense LDL) sind kleine, dichte LDL‑Partikel. Sie verweilen länger im Blut, dringen leichter in die Gefäßwand ein und oxidieren schneller. Entscheidend bleibt jedoch die Partikelzahl insgesamt (ApoB); die Größe ist ein zusätzlicher Hinweis.
TG/HDL‑Quotient ist einfach die Triglyceride durch HDL (beide in mg/dl) teilen. Hohe Werte deuten oft auf Insulinresistenz hin. Heisst, der Körper reagiert weniger gut auf Insulin, dadurch ist die Zucker‑ und Fettverwertung gestört. Ein niedriger Quotient spricht für ein günstiges Stoffwechsel‑Profil.
Hinweis: Auf mmol/l‑Basis ist der Zahlwert niedriger; daher immer auf die Einheit achten.
Kontext zählt! Warum dieselben Zahlen Verschiedenes bedeuten können
Blutfette stehen nie für sich allein. Entzündungen (sichtbar z. B. als erhöhtes Ferritin und/oder erhöhter hsCRP, sind sensitive Entzündungsmarker), die Schilddrüsenfunktion, Leber‑ und Nierenleistung, Hormone, Medikamente und Gewichtsverläufe verschieben das Lipidprofil oft deutlich.
Zur Schilddrüse ist eine Präzisierung wichtig, denn eine Schilddrüsenüberfunktion (Hyperthyreose) zeigt in der Regel ein niedriges TSH bei erhöhtem fT4/fT3. In dieser Situation können Triglyceride und LDL auffallend niedrig, vermeindlich "gut" sein, weil der Stoffwechsel beschleunigt ist. Ein erhöhtes TSH spricht hingegen eher für eine Schilddrüsenunterfunktion (Hypothyreose). Dabei steigt häufig LDL‑C, teils auch Gesamt‑C. Deshalb gehören TSH und fT4 (ggf. fT3) bei Diskrepanzen im Lipidbefund immer dazu.
Ein weiterer Schlüssel liegt in Leber & Galle. Die Leber baut Lipoproteine von VLDL→LDL ab, wandelt Cholesterin in Gallensäuren um und steuert so den Cholesterin‑Kreislauf. Die Galle emulgiert Nahrungsfette und ohne ausreichenden Gallefluss ist die Fettaufnahme gestört. Eine Fettleber (Nicht Alkoholische Fettleber) fördert die VLDL‑ und Triglyceridproduktion. Häufig sind die Blutwerte GammaGT und ALT erhöht und das kardiometabolische Risiko steigt. Bei Galleabfluss‑Störungen (Cholestase) können LDL‑ähnliche Partikel ansteigen und das Laborbild verfälschen. Darum sollten GammaGT, ALT/AST, AP, Bilirubin und, je nach Befund, Bildgebung (z. B. Ultraschall) bei der Interpretation berücksichtigt werden.
Auch sehr niedrige Triglyceride verdienen Kontext. Sie können physiologisch bei sportlicher, kohlenhydratärmerer Ernährung, längeren Nüchternphasen oder nach Gewichtsverlust auftreten. Möglich sind aber auch Ursachen wie Hyperthyreose (niedriges TSH), Malabsorption/Mangelernährung oder seltene genetische Varianten. Der klinische Rahmen entscheidet. Auch Gespräche geben eine mögliche Ursacheneingrenzung. Lebensstilfaktoren bleiben zentrale Stellschrauben. Ausdauer‑ und Krafttraining senken TG und heben HDL, Schlaf und Stressbalance verbessern die Insulinsensitivität, lösliche Ballaststoffe (u.a. Flohsamenschalen, Hafer, Hülsenfrüchte) können LDL messbar senken. Ein moderater Ersatz gesättigter durch ungesättigte Fette (z. B. natives Olivenöl, Nüsse, frischer fetter Fisch) senkt meist LDL/ApoB.
Wie man einen Befund sinnvoll interpretiert. Ein roter Faden
Beginnen Sie mit den Grundwerten (LDL‑C, HDL‑C, TG, Gesamt‑C) und berechnen Sie non‑HDL‑C. Prüfen Sie dann das Verhältnis von TG zu HDL als schnellen Stoffwechsel‑Check. Wenn die Zahlen widersprüchlich wirken, also beispielsweise sehr gutes TG/HDL, aber hohes LDL, lohnt sich der Blick auf ApoB (Partikelzahl) und ggf. Remnant‑Cholesterin. Ergänzend können Lp(a) (einmalig) und bei Spezialfragen, sdLDL/LDL‑P helfen. Parallel werfen Sie einen Blick auf hsCRP & Ferritin, Schilddrüse und die Leber‑/Nierenparameter, damit sekundäre Ursachen nicht übersehen werden.
Beispiel: Januar 2025, was verraten diese Werte?
Im Januar 2025 liegen folgende zentrale Werte vor: Gesamt‑Cholesterin 212 mg/dl, LDL‑Cholesterin 124 mg/dl, HDL‑Cholesterin 84 mg/dl und Triglyceride 53 mg/dl. Zusätzlich wurden ApoB 1,00 g/l und Lp(a) 219,5 nmol/l bestimmt. Entzündlich wirkt der Befund beruhigend, denn hsCRP liegt unter 0,6 mg/l; der Glukosestoffwechsel zeigt sich mit Nüchtern‑Glukose 92 mg/dl und HbA1c 5,5 % unauffällig.

Aus diesen Zahlen lassen sich zwei hilfreiche Größen ableiten.

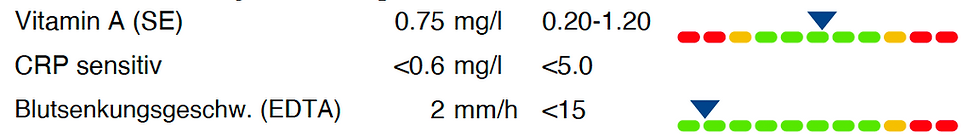
Erstens das non‑HDL‑Cholesterin, also alles Cholesterin in potenziell atherogenen Partikeln: 212 minus 84 ergibt 128 mg/dl. Zweitens das Remnant‑Cholesterin, die praktische Näherung non‑HDL minus LDL, 128 minus 124 ergibt etwa 4 mg/dl. Dieser sehr niedrige Remnant‑Wert spricht gegen eine nennenswerte Belastung durch Triglycerid‑reiche Restpartikel. Der TG/HDL‑Quotient, 53 geteilt durch 84, beträgt 0,63 und weist auf eine sehr gute Insulinsensitivität und wenig kleine, dichte LDL‑Partikel hin.

Wie ist das einzuordnen? Das LDL‑C von 124 mg/dl liegt oberhalb mancher Zielbereiche, ist aber im Kontext der übrigen Daten weniger bedrohlich, als die Einzelzahl vermuten lässt. Entscheidend ist die Partikelzahl, für die ApoB ein guter Stellvertreter ist: 1,00 g/l liegt im Referenzbereich und lässt, zusammen mit dem günstigen TG/HDL‑Profil und dem sehr niedrigen Remnant‑Cholesterin, auf eine eher moderate atherogene Partikellast schließen. Gleichzeitig fällt das deutlich erhöhte Lp(a) von 219,5 nmol/l ins Gewicht. Lp(a) ist genetisch geprägt und wirkt risikoerhöhend unabhängig von anderen Lipidwerten. In der Praxis bedeutet das, selbst bei ansonsten günstiger Konstellation lohnt es sich, die ApoB‑haltige Partikelzahl möglichst niedrig zu halten, Blutdruck, Blutzucker, Entzündung und Lebensstil konsequent zu optimieren und das individuelle Gesamtrisiko zu gewichten. Hilfreich ist der Blick auf die Entwicklung,

im November 2024 lag das LDL‑C bei 144 mg/dl, das HDL bei 91 mg/dl und die Triglyceride bei 42 mg/dl. Das LDL hat sich seitdem verbessert, während HDL hoch blieb und die Triglyceride niedrig sind. Zusammen mit dem aktuell sehr niedrigen hsCRP und dem stabilen Glukosestoffwechsel ergibt sich ein Bild, das metabolisch günstig ist, aber aufgrund des hohen Lp(a) weiterhin eine konsequente Prävention rechtfertigt.
Was folgt daraus im Alltag? Die Fettqualität der Ernährung entscheidet oft mehr als die Fettmenge: Ein schrittweiser Ersatz gesättigter Fette durch ungesättigte, z. B. natives Olivenöl, Nüsse, frischer fetter Seefisch, senkt in der Regel LDL‑C/ApoB. Lösliche Ballaststoffe, wie etwa aus Akazienfasern, Hafer, Hülsenfrüchten oder Flohsamenschalen, sowie unlösliche Ballaststoffe wie Weizenkeime können zusätzlich helfen. Regelmäßige Ausdauer‑ und Krafteinheiten stabilisieren das günstige TG/HDL‑Profil. Schlaf, Stressreduktion und moderater Alkoholkonsum unterstützen den Stoffwechsel. Omega‑3‑Fettsäuren senken Triglyceride und sind bei ohnehin sehr niedrigen TG eher eine ergänzende Option. Bei ausgeprägt erhöhtem Lp(a) und bestehendem Gesamtrisiko wird, ärztlich begleitet, oft eine stärkere LDL/ApoB‑Senkung erwogen. Spezifische Lp(a)‑Therapien befinden sich in der Entwicklung. Wichtig bleibt die Verlaufskontrolle in stabiler Gewichtslage! So lässt sich prüfen, wie stark Lebensstil‑Maßnahmen wirken und ob weitere Schritte sinnvoll sind.
Die hier vorliegenden Werte sind meine eigenen und ich lasse diese zwei Mal jährlich überprüfen.
Was folgt daraus? Von der Zahl zur Handlung
Aus den Zahlen lassen sich klare, alltagstaugliche Schritte ableiten. Bei hohem LDL/ApoB trotz guter übriger Marker lohnt es sich, die Fettqualität der Ernährung zu justieren und mehr ungesättigte, weniger gesättigte Fette, sowie lösliche & unlösliche Ballaststoffe zu erhöhen und konsequent auf Bewegung, Schlaf und Stressbalance zu achten. Omega‑3‑Fettsäuren können Triglyceride senken. Hochdosierte, ärztlich verordnete Präparate zeigen in bestimmten Gruppen auch eine Ereignisreduktion. Reichen Lebensstil‑Maßnahmen nicht aus oder bestehen genetische Faktoren wie ein sehr hohes Lp(a), kommen, ärztlich begleitet, medikamentöse Optionen in Betracht, z. B. Statine, Ezetimib, PCSK9‑Hemmer, Bempedoinsäure.
Wichtig: Nahrungsergänzung kann sinnvoll ergänzen, sie ersetzt keine notwendige Therapie. Umgekehrt ist keine Zahl in Stein gemeißelt und mit konsequentem Lebensstil lassen sich Lipidprofile oft deutlich verbessern.
Wichtige Begriffe noch kurz erklärt
Lipoproteine: Transportkügelchen aus Fett und Eiweiß, die Fettstoffe im Blut bewegen.
Atherosklerose: Langsamer Prozess, bei dem sich Stoffe in der Gefäßwand anreichern und diese verhärten.
ApoB: Eiweiß‑"Markierung" auf jedem atherogenen Partikel; gibt indirekt die Stückzahl dieser Partikel an.
Lp(a): Genetisch bestimmtes Spezial‑Lipoprotein; erhöhtes Lp(a) steigert das Risiko unabhängig von anderen Werten.
Remnants/Remnant‑Cholesterin: "Reste" nach dem Abbau triglyceridreicher Partikel; besonders gefäßaktiv.
sdLDL: Kleine, dichte LDL‑Partikel; leichter gefäßgängig und oxidationsanfälliger.
Insulinresistenz: Körperzellen sprechen schlechter auf Insulin an; Zucker‑ und Fettstoffwechsel geraten aus dem Takt.
hsCRP: Sensitiver Blutwert, der stille Entzündungen sichtbar macht.
non‑HDL‑C: Alles Cholesterin in potentiell atherogenen Partikeln (Gesamt‑C minus HDL).
TG/HDL‑Quotient: Einfache Verhältniszahl aus Triglyceriden und HDL; Hinweis auf Insulinsensitivität.
So nutzen ich die Interpretation
In der praktischen Arbeit starte ich mit den Basiswerten (LDL‑C, HDL‑C, TG, Gesamt‑C) und berechne non‑HDL‑C. Anschließend prüfe ich den TG/HDL‑Quotienten als schnellen Stoffwechsel‑Indikator. Wenn Zahlen widersprüchlich wirken, etwa sehr gutes TG/HDL, aber erhöhtes LDL, klärt ApoB als Partikelzähler die atherogene Last. Ergänzend betrachte ich Remnant‑Cholesterin, einmalig lasse ich Lp(a) als genetischen Risikofaktor bestimmen.
"Über den Tellerrand" ziehe ich je nach Fragestellung und Sympthomatiken weitere Marker heran, um Korrelationen und Kausalitäten besser zu verstehen:
TSH, fT4 (ggf. fT3) zur Erkennung von Schilddrüsen‑Einflüssen (Hyperthyreose → niedriges TSH; Hypothyreose → hohes TSH).
Leber‑/Galle‑Parameter (GGT, ALT/AST, AP, Bilirubin) zur Einschätzung von VLDL/TG‑Produktion, Cholestase und Gallensäuren‑Metabolismus.
ApoA1 und die ApoB/ApoA1‑Relation als Spiegel von "atherogener Last" zu "anti‑atherogener Kapazität".
sdLDL bzw. LDL‑P (z. B. NMR) bei Spezialfragen zur Partikelqualität/‑zahl.
Nüchtern‑Insulin/HOMA‑IR für die Insulinresistenz, Cystatin C/eGFR für den Nierenkontext.
Aus der Gesamtschau entsteht ein individueller Maßnahmenplan, der Prioritäten verständlich macht, Leber‑ und Gallengesundheit einbezieht und im Verlauf überprüft wird.
Wie "gut" das im Volksmund "gute Cholesterin" tatsächlich ist und ob es überhaupt richtig funktioniert, erörtere ich in einem separaten Blog-Beitrag, den es sich zu lesen lohnt.
Quellen
Mach F, Baigent C, Catapano AL, et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias. European Heart Journal. 2020; 41(1): 111 - 188.
Glavinovic T, Thanassoulis G, et al. Physiological Bases for the Superiority of Apolipoprotein B Over LDL-Cholesterol. Journal of the American Heart Association. 2022; 11: e025858.
Contois JH, et al. Standardization of ApoB, LDL-C and Non-HDL-C; clinical implications. Journal of the American Heart Association. 2023; 12: e030405.
Sniderman AD, et al. Discordance among apoB, non-HDL-C and LDL-C and implications for risk. European Heart Journal. 2024; 45(27): 2410 - 2422.
Kronenberg F, et al. European Atherosclerosis Society Consensus Statement on Lipoprotein(a). European Heart Journal. 2022; 43(39): 3925 - 3946.
Kronenberg F, et al. Frequently asked questions on the 2022 Lp(a) consensus. Atherosclerosis. 2023; 368: 56 - 65.
Varbo A, Benn M, Nordestgaard BG. Remnant cholesterol as a causal risk factor for ischaemic heart disease. Journal of the American College of Cardiology. 2013; 61: 427 - 436.
Quispe R, Martin SS, Michos ED. Remnant cholesterol predicts cardiovascular disease: evidence and clinical implications. Current Opinion in Lipidology. 2021; 32: 351 - 359.
Doi T, et al. Elevated remnant cholesterol reclassifies risk of myocardial infarction and ischaemic heart disease. Journal of the American College of Cardiology. 2022; 79: 2383 - 2397.
Wadström BN, et al. Remnant cholesterol, not LDL-C, explains risk of peripheral artery disease and chronic limb-threatening ischaemia. Arteriosclerosis, Thrombosis, and Vascular Biology. 2024.
Khera AV, et al. Cholesterol efflux capacity, HDL function, and atherosclerosis. New England Journal of Medicine. 2011; 364: 127 - 135.
Rohatgi A, et al. HDL cholesterol efflux capacity and incident cardiovascular events. New England Journal of Medicine. 2014; 371: 2383 - 2393.
Mackey RH, et al. HDL-cholesterol and HDL particle concentrations in relation to coronary heart disease. Journal of the American College of Cardiology. 2012; 60: 508 - 516.
McLaughlin T, et al. Is there a simple way to identify insulin-resistant individuals? American Journal of Cardiology. 2005; 96: 399 - 404.
Yuge H, et al. Triglyceride-to-HDL-cholesterol ratio predicts 10-year type 2 diabetes better than individual lipids. Scientific Reports. 2023; 13: 20533.
Che B, et al. Baseline TyG-Index and TG/HDL-C associated with cardiovascular risk in the UK Biobank. Cardiovascular Diabetology. 2023; 22: 237.
Sumner AE, et al. Limitations of the TG/HDL marker in African American populations. Archives of Internal Medicine. 2005; 165: 1395 - 1400.
Hooper L, et al. Reduction in saturated fat intake for cardiovascular disease. Cochrane Database of Systematic Reviews. 2020; CD011737.
Sacks FM, et al. American Heart Association Presidential Advisory on Dietary Fats and Cardiovascular Disease. Circulation. 2017; 136: e1 - e23.
Bhatt DL, et al. Cardiovascular risk reduction with icosapent ethyl (REDUCE-IT). New England Journal of Medicine. 2019; 380: 11 - 22.
Nicholls SJ, et al. Effects of omega-3 carboxylic acids in statin-treated patients at high cardiovascular risk (STRENGTH). JAMA. 2020; 324: 2268 - 2280.
Nordestgaard BG, et al. Fasting is not routinely required for lipid profile testing. European Heart Journal. 2016; 37: 1944 - 1958.
EASL–EASD–EASO. Clinical Practice Guidelines on metabolic dysfunction-associated steatotic liver disease (MASLD). Journal of Hepatology. 2024; 81: 492 - 542.
Martin A, et al. Management of dyslipidemia in nonalcoholic fatty liver disease. Current Atherosclerosis Reports. 2022; 24: 663 - 676.
Duran EK, et al. Triglyceride-rich lipoprotein cholesterol and small dense LDL in event prediction. Journal of the American College of Cardiology. 2020; 75: 2122 - 2135.
Duntas LH. Thyroid disease and lipids. Thyroid. 2002; 12: 287 - 293.
Rizos CV, et al. Effects of thyroid dysfunction on lipid profile. The Open Cardiovascular Medicine Journal. 2011; 5: 76 - 84.
Liu H, et al. Dyslipidemia in hypothyroidism: mechanisms and clinical implications. Endocrine Connections. 2022; 11: e210002.
Rosenson RS, et al. HDL metrics, particle number, function and therapeutic targets. Nature Reviews Cardiology. 2016; 13: 48 - 60.
Tall AR, Rader DJ. The trials and tribulations of CETP inhibitors. Circulation Research. 2018; 122: 106 - 112.





Kommentare